Relato de Experiência Profa. Regiane Cristina Mareze Sipioni Castione - Biodiesel
Relato de Experiência Disciplina: Química – 3 Ano - EMTítulo do trabalho: Biodiesel
Nome da professora: Regiane Cristina Mareze Sipioni Castione
Estabelecimento de Ensino/Cidade: Colégio Estadual Professor Flávio Warken – EFMP – Foz do Iguaçu/PR
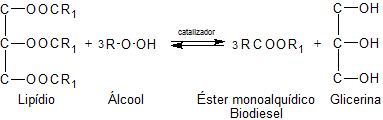
Objetivos: produzir biodiesel através de uma reação de transesterificação, em que se verificará o efeito da quantidade de catalisador na transesterificação do óleo de soja comercial.
Procedimento
Parte A
- Identifique quatro tubos de ensaio e adicione:
(b) 2 mL de água, 2 mL de óleo vegetal e 1 gota de detergente;
(c) 2 mL de solução saturada de NaCl e 2 mL de óleo vegetal;
(d) 2 mL de solução saturada de NaCl, 2 mL de óleo vegetal e 1 gota de detergente.
- Agite os tubos e deixe-os em repouso por 20 min. Observe o comportamento das fases aquosa e de óleo.
Parte B - Efeito da quantidade de catalisador na síntese do Biodiesel
Procedimento 1 - preparo do catalizador com metanol
- Utilize as seguintes quantidades de catalisador (KOH): 0,50; 1,0; 2,5 e 5,0% m/m para cada 50mL de óleo vegetal.
- Prepare o catalizador na capela. Adicione em um erlenmeyer de 125 mL seco, 14,0 mL de metanol p.a, em seguida a quantidade desejada do catalisador(KOH).
- Coloque a barra magnética no erlenmeyer, cubra a boca do frasco com papel alumínio e inicie a agitação.
Procedimento 2 - reação de transesterificação
- Após a completa dissolução do KOH no metanol, interromper a agitação e adicionar 50,0 g de óleo de soja ao frasco.
- Cubra novamente a boca do erlenmeyer com papel alumínio.
- Agite a mistura moderadamente por 30 min.
- Anote os tempos de mudanças de coloração e homogeneidade da mistura durante a reação.
- Transfira o conteúdo do erlenmeyer para uma proveta de 100 mL ou então um funil de decantação. Acompanhe a separação de fases por 1 h.
- Tente identificar em qual mistura há a melhor separação de fases.
- Usando uma pipeta graduada, retire 2 alíquotas de 2 mL da fase inferior e da fase superior.
- Teste a miscibilidade dessas fases com etanol e hexano (éter de petróleo).
- Retire 2 mL da fase de biodiesel e adicione 2 mL de água.
- Agite muito levemente a mistura. Anote as características da fase aquosa.
- Transfira o restante da fase de biodiesel para uma outra proveta de 100 mL e adicione pequenas porções de solução saturada de NaCl, agitando suavemente.
- Espere as fases separarem e reserve para posterior teste de viscosidade.


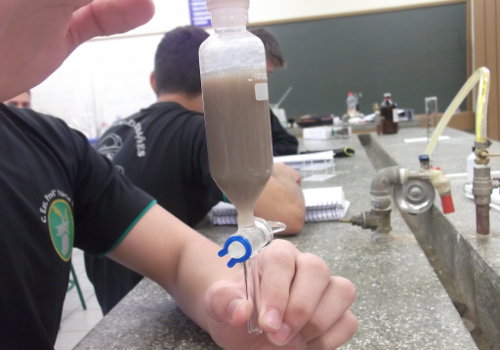
Mistura do catalizador com o óleo



Separação das fases

Biodiesel e glicerina
Sugestões para realização do experimento quando não tiver recursos disponíveis para fazer as etapas acima descritas
Procedimento
- Medir 50mL de óleo em uma proveta e transferir para um erlenmeyer
- Adicionar o catalizador (preparado previamente)
- Agitar a mistura ou com agitador magnético ou então manualmente por cerca de 15 min
- Deixar em repouso por uma hora aproximadamente
- Observar as fases e identificá-las utilizando a densidade da glicerina e do biodiesel
- Lavagem do biodiesel com solução supersaturada de sal de cozinha
- Adicionar na mistura (biodiesel/glicerina) um pouco da solução saturada de sal de cozinha, agitar e deixar em repouso por 30 min. Observar as fases e identificar através da densidade.
Resultados


Reação feita na proveta.
Discussão
Neste experimento estamos apenas observando como se processa uma reação de transesterificação e como a ação do catalizador influencia no processo. Fizemos algumas adequações, pois nem sempre temos todos os recursos disponíveis no laboratório.O biodiesel é um combustível obtido a partir de matérias-primas de diversos vegetais, entre eles podemos citar o óleo de soja, o óleo de soja reciclado, óleo de milho, óleo de dendê, óleo de girassol, gordura animal (sebo bovino) ou outras.
Após o óleo separado em biodiesel e glicerina, faz-se o processo de decantação. Como a glicerina é mais densa que o biodiesel, ela ficará na porção de baixo do decantador, então é só retirá-la.
O biodiesel obtido no experimento não está pronto para se utilizar, ainda é necessário submetê-lo ao processo de lavagem e filtração para remoção das impurezas que podem estar presentes nele.
Caso utilize óleo reciclado, é necessário lavar este antes de adicionar o catalizador e fazer a separação das fases. Esta lavagem é feita com água e sal, o sal age de forma a absorver as impurezas e a água serve para diluir o sal.
Durante o início da reação, pode-se observar mudanças de coloração, que vão do verde musgo ao amarelo; percebe-se também alterações na sua viscosidade, podendo também percebermos um leve aquecimento na mistura.
Deve-se tomar cuidado, pois pode aparecer a formação de sabão no processo. Escolhemos o metanol para preparar o biodiesel. Na mesma taxa de conversão (e mesmas condições operacionais), o tempo de reação é menos da metade do tempo quando se emprega o etanol.
O etanol apresenta a desvantagem, pois estes têm com os ésteres etílicos maior afinidade à glicerina, dificultando a separação e aumenta a possibilidade de se obter sabão.
A catálise em meio alcalino é muito mais rápida que em meio ácido, por isso escolhemos o hidróxido de potássio como catalizador.
Durante a reação de transesterificação pode aparecer água e esta é indesejável, pois hidrolisa o óleo vegetal e/ou biodiesel, levando a formação de ácido graxo livre. Por sua vez, este reage com o metal do catalisador, produzindo sabões que, além de reduzirem o rendimento da reação, dificultam também as próximas etapas, tais como lavagem e separação do biodiesel.
É interessante observar que dependendo do grupo que está realizando o experimento, se não fizer a agitação rápida, aparecerá uma emulsão e formação de sabão.
Deve-se ter cuidado ao manusear o metanol, este é um líquido volátil, inflamável e tóxico, por isso deve ser manipulado na capela e com pêra de sucção. Recomendamos sempre que todas as janelas e portas do laboratório estejam abertas.
Existe para este experimento várias observações e discussões que podem ser exploradas pelos professores, inclusive conteúdos básicos do 2º ano do ensino médio.
Este experimento pode também ser feito em garrafa PET.
Conclusão
Podemos dizer que este experimento proporciona ao aluno vários questionamentos e principalmente lhe dá subsídios para adquirir conhecimento tanto na área da Química, Geografia, Biologia e Meio Ambiente.Fontes
http://pt.wikipedia.org/wiki/Biodiesel acesso em 22/04/2013.http://www.crq4.org.br/informativomat_249 acesso em 22/04/2013.

